Der Schwerpunkt der Forschungsarbeiten war die Chemie und Physik von hoch lichtechten Fluoreszenzfarbstoffen. Es wurden Synthesen für neue Fluoreszenzfarbstoffe entwickelt und die Reaktionen der Substanzen untersucht. Wegen ihren ungewöhnlichen Eigenschaften sind sie z.B. als Laserfarbstoffe und für Lichtsammelsysteme von Interesse. Darüber hinaus konnten auf ihrer Basis verschiedene analytische Nachweisverfahren entwickelt werden, z.B. für die immunologische Spuren-Bestimmung. Dieses wurde u.a. für den Nachweis von Schadstoffen im Wasserkreislauf eingesetzt. Optische Fluoreszenz-Datenspeicher sind auf der Basis der von uns synthetisierten Farbstoffe entwickelt worden und werden weiter ausgebaut.
Neben diesen Farbstoff-spezifischen Arbeiten wurden diverse reaktionsmechanistische Fragestellungen bearbeitet, so z.B. über die Quantifizierung von Solvens-Effekten bei chemischen Reaktionen in binären Gemischen und über die Mechanismen von Umlagerungsreaktionen. Weitere Arbeitsgebiete betrafen polymerchemische Fragestellungen.
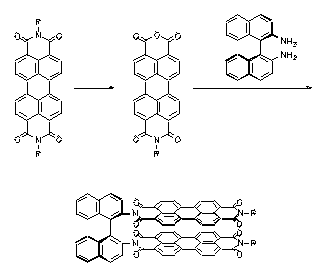
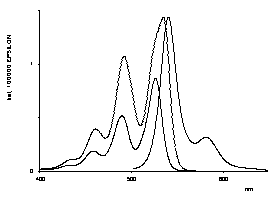
Bichromophore Perylenfarbstoffe sind synthetisiert worden, bei denen die zwei Chromophore über eine Binaphthyl-Einheit verbunden sind. Starke Excitonenkopplungen der zwei Chromophore, eine bathochrom verschobene Fluoreszenz und starke CD-Effekte werden dadurch induziert. Die neu dargestellten Farbstoffe sind interessante Modell-Systeme für das Photosynthese-Reaktionszentrum.
 |
 |
 |
 |
 |
Natürliches und künstliches |
UV/Vis- und CD-Spektren des künstlichen |
· Heinz Langhals, Josef Gold, Liebigs Ann./Recueil, 1997, 1151-1153. J. Karolin, L. B.-Å. Johansson, U. Ring, H. Langhals, Spectrochim. Acta A 1996, 52, 747-753.
Drei Perylenfarbstoff-Chromophore sind in m-Position mit einem Benzolring verknüpft worden, so daß Through-Bond-Wechselwirkungen minimalisiert werden und Through-Space-Wechselwirkungen studiert werden können, die zu einer bathochromen Farbverschiebung führen, aus der auf eine leichte Destabilisierung des Gesamtsystems geschlossen werden kann. Dies ist für das Problem der "Longicyclics" von Interesse, das bisher an dem gespannten Kohlenwasserstoff Barrelen bearbeitet worden ist.
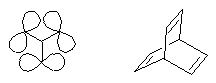
Longicyclics · · · · · · · Barrelen |
 |
· Heinz Langhals, Josef Gold, J. Prakt. Chem. 1996, 338, 654-659.
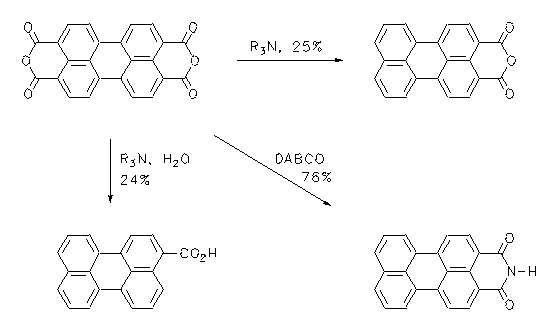
Das als Farbstoff-Zwischenprodukt wichtige Perylen-3,4-dicarbonsäureanhydrid wird einstufig aus technischem Perylen-3,4:9,10-tetracarbonsäurebisanhydrid durch eine entropiegesteuerte partielle Decarboxylierung in Gegenwart nicht kondensierender Amine in 25% dargestellt. Perylen-3-carbonsäure und Perylen-3,4-dicarbonsäureimid werden nach dem gleichen Konzept in 24% bzw. 76% dargestellt.
 |
· Heinz Langhals, Petra von Unold, Markus Speckbacher, Liebigs Ann./Recueil 1997, 467-468.
Leichtlösliche, lichtechte, stark rot fluoreszierende Farbstoffe sind durch die Kondensation von Perylentetracarbonsäurebisanhydrid oder Perylenanhydridimiden durch die Kondensation mit 1,3-Diaminen dargestellt worden, die geminale langkettige Alkylgruppen tragen.
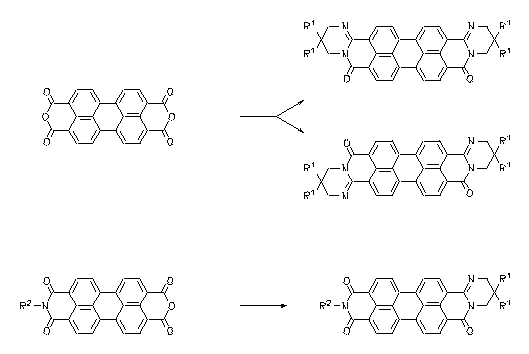 |
· Heinz Langhals, Haleh Bastani-Oskoui, J. Prakt. Chem. 1997, 339, 597-602.
Pyrrolo- und Thiophenoperylenimide werden durch eine reduktive Cyclisierung aus entsprechenden Nitroperylenderivaten erhalten und sind stark fluoreszierende Heterocyclen, die sich leicht monofunktionalisieren lassen und für Fluoreszenzmarkierungen eignen.
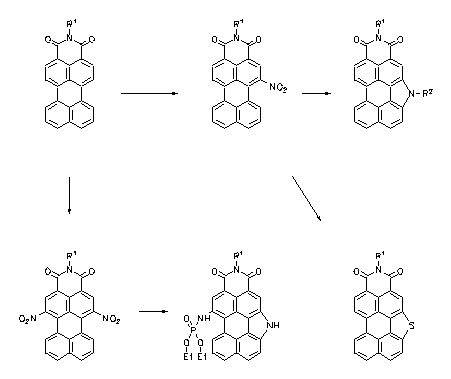 |
· Heinz Langhals, Leonhard Feiler, Liebigs Ann. 1996, 1587-1591.
Eine neue Umlagerungsreaktion von aromatischen Bisimiden wurde gefunden, mit der Derivate aromatischer Aminocarbonsäuren dargestellt werden können. Die Reaktion wurde an den Beispielen der Naphthalin- und Perylentetracarbonsäurebisimide verifiziert, aus denen Farbstoffe erhalten werden, die z.Tl. sehr stark fluoreszieren. Mit deren Untersuchung ist eine neue experimentelle Basis für den "Loose-Bolt"-Mechanismus geschaffen worden.
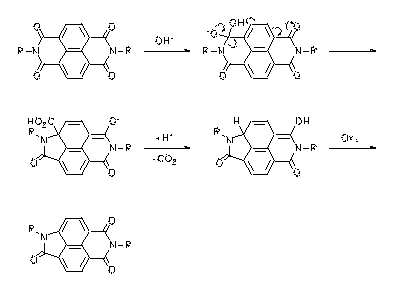 |
· Heinz Langhals, Petra von Unold, GIT Fachz. Lab. 1997, 41, 974-978. H. Langhals, P. v. Unold, Angew. Chem. 1995, 107, 2436-2439; Angew. Chem., Int. Ed. Engl. 1995, 34, 2234-2236.
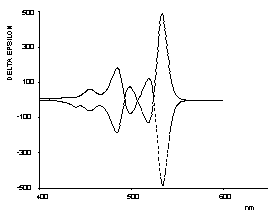
Oxindigo hat wegen seiner verhältnismäßig kurzwelligen Absorption (413 nm in Cyclohexan), geringen Extinktion (13800), fehlender Fluoreszenz und schlechter Zugänglichkeit als chromophores System im Gegensatz zu seinem Stickstoff-Analogen (Indigo) oder dem Schwefel-Analogen (Thioindigo) keinerlei technische Bedeutung als Farbstoff erlangt und war auch Gegenstand nur weniger Arbeiten. Substituiert man ihn jedoch in den Konjugations-ermöglichenden Positionen 6 und 6' mit Donor-Gruppen, dann erhält man langwellig absorbierende Substanzen, die sich durch eine ausgeprägte Fluoreszenz in Lösung auszeichen (siehe Abbildung). Im Gegensatz zu Indigo absorbiert die cis-Form bei den neuen Farbstoffen längerwellig als die trans-Form und bildet bereits blaue Lösungen. Der Feststoff- der cis-Form fluoresziert im NIR-Bereich.
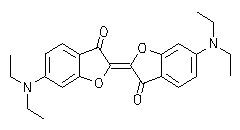 |
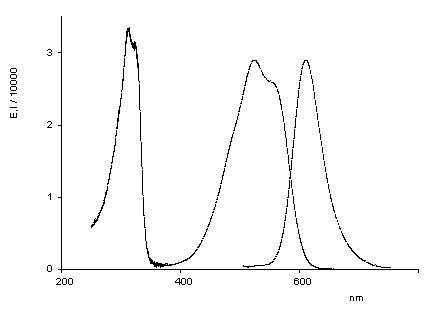 UV/Vis-Absorptions- und Fluoreszenzspektrum von trans-Oxindigo in CHCl3 (Farbkoordinaten: x = 0.3791, y = 0.2169, z = 0.4040 bei Tmax= 0.1). |
Oxindigo-Derivate liessen sich entgegen der Literatur nicht aus Cumaranon und Dischwefeldichlorid darstellen, da hierbei ein Tetrathian gebildet wird. Die Synthese gelingt jedoch aus Halogenessigsäurederivaten und dem entsprechenden Phenol.
 |
 |
· Heinz Langhals, Barbara Wagner, Angew. Chem. 1996, 108, 1090-1093; Angew. Chem. Int. Ed. Engl. 1996, 35, 1016-1019. H. Langhals, B. Wagner, K. Polborn, Tetrahedron, 1996, 52, 1961-1964.
N-Aryldiketopyrrolopyrrole werden durch die Kondensation der entsprechenden Lactone mit Arylaminen in Gegenwart von Hilfsstoffen wie Dicyclohexylcarbodiimid dargestellt und bilden leuchtend rote Pigmente mit einer roten bis orangeroten Feststofffluoreszenz.
 |
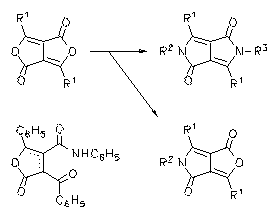 |
· H. Langhals, T. Grundei, T. Potrawa, K. Polborn, Liebigs Ann. 1996, 679-682.
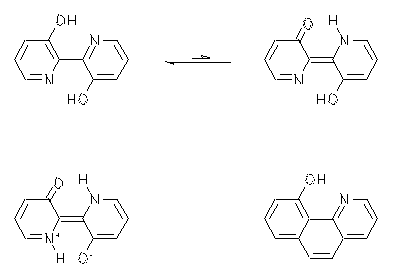
2,2'-Bipyridin-3,3'-diol ist als Fluoreszenzfarbstoff von besonderem Interesse, da sein Stokes-Shift 100 nm beträgt. In der Literatur wird hierfür ein intramolekularer Zweiprotonentransfer nach der optischen Anregung verantwortlich gemacht. Solche Tautomere sollen nur im angeregten Zustand stabil sein, während im elektronischen Grundzustand keine Energieminima für Tautomere Strukturen vorliegen sollen. Die stärkste Stütze für den Zweiprotonentransfer ist eine sehr schwache Solvatochromie des Farbstoffs in Absorption und Fluoreszenz, die als Indiz für eine Punktsymmetrie des Grund- und angeregten Zustands aufgefaßt werden kann.
Entgegen der Literatur wurde aber eine schwache UV/Vis-Absorption gefunden, die insbesondere in polaren Solvenzien stärker ausfällt und charakteristisch für Tautomere des Farbstoffs ist. Zudem wurde gefunden, daß bei einem strukturähnlichen Phenanthridin, bei dem nur eine Einprotonenübertragung möglich ist, eine ähnlich geringe Solvatochromie wie beim Bipyridyl vorliegt, so daß die Argumente in der Literatur zumindest als außerordentlich schwach zu bezeichnen sind.
 |
· L. B.-Å. Johansson, L. Persson, H. Langhals, J. Chem. Soc., Faraday Trans., 1996, 92, 4909-4911.
1. H. Langhals, P. von Unold, 'Arylimid-Lactam-Ringverengungsreaktionen - ein neuer Typ von Umlagerungen', GIT Fachz. Lab. 1997, 41, 974-978.
2. H. Langhals, J. Gold, 'Chiral Bifluorophoric Perylene Dyes with Unusually High CD Effects - a Simple Model for the Photosynthesis Reaction Center', Liebigs Ann./Recueil, 1997,1151-1153.
3. H. Langhals, P. von Unold, M. Speckbacher, 'Balanced Decarboxylation of Aromatic Polyacids - a One-Step Synthesis of Perylene 3,4-dicarboxylic Anhydride', Liebigs Ann./Recueil 1997, 467-468.
4. H. Langhals, H. Bastani-Oskoui, 'Synthesis of Readily Soluble Tetraazaviolanthrone and -isoviolanthrone Fluorescent Dyes', J. Prakt. Chem. 1997, 339, 597-602.
5. L. B.-Å:. Johansson, L. Persson, H. Langhals, 'Conspicuous absorption and fluorescence spectroscopic properties of 3,3'-dihydroxy-2,2'-bipyridines in solution', J. Chem. Soc., Faraday Trans., 1996, 92, 4909-4911.
6. J. Karolin, L. B.-Å. Johansson, U. Ring, H. Langhals, 'Aggregation of perylene dyes in lipid vesicles: the effect of optically active substituents', Spectrochim. Acta A 1996, 52, 747-753.
7. H. Langhals, L. Feiler, 'Pyrrolo- and Thiophenoperylenedicarboximides - Highly Fluorescent Heterocycles', Liebigs Ann. 1996, 1587-1591.
8. H. Langhals, J. Gold, 'Tangentially Coupled p Systems and their Through-Space Interaction - Trichromophoric Perylene Dyes', J. Prakt. Chem. 1996, 338, 654-659.
9. H. Langhals, B. Wagner, 'Oxindigo: Colour Deepening, Strong Fluorescence and Large Stokes-Shift by Donor-Substitution', Angew. Chem. 1996, 108, 1090-1093; Angew. Chem. Int. Ed. Engl. 1996, 35, 1016-1019.
10. H. Langhals, B. Wagner, K. Polborn, 'The Oxydative Coupling of Coumaranone with Disulfurbichloride', Tetrahedron 1996, 52, 1961-1964.
11. H. Langhals, T. Grundei, T. Potrawa, K. Polborn, 'Highly Photostable Organic Fluorescent Pigments - A Simple Synthesis of N-Arylpyrrolopyrrolediones (DPP)', Liebigs Ann. 1996, 679-682.
1. H. Langhals, W. Jona, 'Perylenfarbstoff-Kronenether: Fluoreszenz-Komplexbildner für Metallionen', Ger. Offen. DE 19709008.7 (March 5, 1997).
2. H. Langhals, W. Jona, 'Ein selbsdispergierender organischer Farbstoff', Ger. Offen. DE 19709004.4 (March 5, 1997).
3. H. Langhals, J. Gold, 'Bifluorophore Perylenfarbstoffe mit langwellig verschobener Fluoreszenz', Ger. Offen. DE 19702826.8 (January 27, 1997).
4. H. Langhals, P. von Unold, 'Die ausbalancierte Decarboxylierung von aromatischen Polycarbonsäuren - eine einstufige Synthese von Perylen-3,4-dicarbonsäureanhydrid', Ger. Offen. DE 19700990.5 (January 14, 1997).
5. H. Langhals, L. Feiler, 'Pyrrolo- und Thiophenoperylenimide - stark fluoreszierende Heterocyclen', Ger. Offen. DE 19651712.5 (December 12, 1996).
6. H.Langhals, B. Hock, R. A. Brosius, 'Die immunochemische Bestimmung von Azofarbstoffen', Ger. Offen. DE 19651599.8 (December 11, 1996).
7. H. Langhals, B. Wagner, 'Donor-substituted oxindigo derivatives and their use as colorants', Ger. Offen. DE 19616532.6 (April 25, 1996); PCT Int. Appl. WO 9741176; Chem. Abstr. 1998, 128, 4661a.
H. Langhals, 2009. - Impressum - Datenschutz - Kontakt